原文标题:DNA replication-coupled histone modification maintains Polycomb gene silencing in plants
中文标题:植物中与DNA复制协同的组蛋白修饰保证了转录起始基因的沉默
文章作者:Danhua Jiang and Frédéric Berger
发表单位:Gregor Mendel Institute, Austrian Academy of Sciences, Vienna Biocenter, Dr. Bohr-Gasse 3, 1030 Vienna, Austria.
期刊:Science, 2017
解读人:王宁博士
摘要
细胞周期中基因表达模式的传递需要DNA复制后表观遗传学标记的恢复。文中数据表明植物细胞在DNA复制过程中协同修饰组蛋白H3.1,以恢复其转录抑制标记H3K27me3的水平。植物进化出了高效三甲基化修饰组蛋白H3.1 K27的机制,从而保证了从母细胞到子细胞沉默记忆的传递。文章阐明了在植物从营养生长到生殖生长的过程中,该机制如何建立H3K27me3介导的沉默。这项研究揭示了在植物细胞分裂过程中控制H3K27me3转变,保证H3K27me3作为表观标记发挥功能的机制。
研究背景
表观标记参与维持从母细胞到子细胞的基因表达模式。在DNA复制过程中,复制叉破坏了染色质的结构,而在其复制后的G2期,保持转录的模式稳定需要表观遗传标记的恢复。在复制点,核小体由再循环的组蛋白以及新合成的、大部分未被修饰的组蛋白重新组装。与组蛋白H3.3相比,H3.1通过CAF1(染色质组装因子1)定位到复制叉处。而DNA复制过程中,转录起始抑制因子PRC2甲基化H3K27me3,从而保持对转录抑制作用。这一机制在动植物中高度保守。
在完成DNA复制的哺乳动物细胞中,H3K27me3的水平只在细胞分裂下一个G1期恢复,可能是PRC2从细胞分裂S期H3K27me1到G1期H3K27me3的逐步对K27进行甲基化的结果。与动物不同,植物进化出了不依赖PRC2,而能介导H3.1 K27me1的甲基转移酶ATXR5和ATXR6。因此,H3K27me3的动态恢复可能在动植物中存在差异。为说明这个问题,文中同步了烟草BY-2细胞系的细胞周期并检测了H3K27me1和H3K27me3的水平。在S期,H3K27me1的水平没有变化,这与ATXR5/6在复制叉处的结合相一致。相比之下,H3K27me3的水平在S期下降,这可能与新合成未修饰组蛋白有关。之后,在G2早期,H3K27me3的水平恢复,并且在达到另一个G1期之前保持稳定。这一现象与动物细胞H3K27me3水平的缓慢恢复不同,表明在植物中可能存在特殊的机制,保证了DNA复制后H3K27me3水平的快速恢复。
实验结果
我们假设H3K27me3水平的恢复依赖于H3.1,因为ATXR5和ATXR6优先单甲基化H3.1的K27。实验表明在拟南芥中CAF1定位H3.1于复制叉。而在酵母双杂交试验中,保守的CAF1亚基FAS1能够与PRC2和PRC1的成分相结合。另外,FAS1能够与复制叉处的PCNA1/2互作。体外的Pull-down实验和体内的CO-IP实验进一步确认了FAS1和PCAN1/2, CLF,LHP1以及RING1A的互作。另外,CO-IP实验也证明LHP1和PCNA1/2之间存在互作。与这些互作相一致,FAS1和PRC蛋白共定位于复制叉,并且PRC2和PRC1在复制点与CAF1互作。
为证明H3.1的参与是否促进K27me3的恢复,我们用了H3.1缺陷突变体。拟南芥中H3.1由5个基因编码。利用miRNA敲除htr1;htr2;htr3;htr9四敲除突变体中的htr13,获得htr13表达下调的突变体。这些htr13表达下调的突变体都表现出相似的发育缺陷,表现为花序分生组织增大、扁茎、叶片生长错位,以及荚果变短等。这些发育缺陷可以被H3.1恢复,但不能被H3.3、以及H3.1启动子启动的H3.3恢复。这些结果表明H3.1在植物发育过程中具有特殊功能。
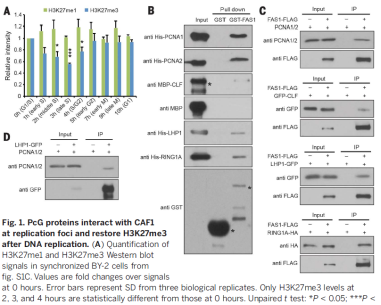
在H3.1敲除突变体中,H3K27me1和H3K27me3的水平都有降低,而H3K4me3的水平没有变化。通过CHIP-seq发现染色质上H3K27me3的大规模缺失,而H3K27me3的总体模式保留了下来。另外,h3.1kd中上调表达的基因与H3K27me3调控的基因显著重合,包括KNOX基因。另外,KNOX基因在突变体的叶片中异位表达,这也与突变体的叶片异位生长表型一致,因此,H3.1表达水平的降低模拟了H3K27me3的缺失。
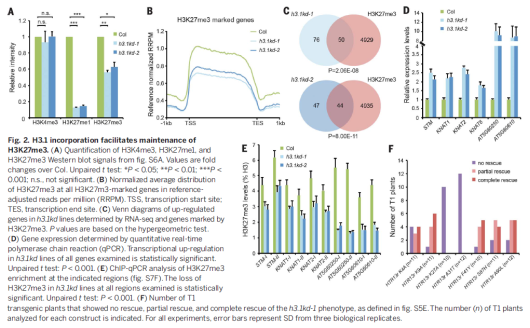
在h3.1kd中,H3K27me3的缺失既不是PcG基因或H3K27去甲基化酶的错误表达,也不是细胞周期的紊乱所造成。为检测H3.1是否作为K27me3的底物,影响了H3K27me3活性的保持,文中构建了点突变体H3.1K4A, H3.1K9A和H3.1K27A。结果发现只有H3.1K27A不能恢复突变体的发育缺陷、H3K27me3水平以及KNOX基因的表达。这些结果表明H3.1作为底物,在H3K27me3的遗传过程中发挥重要作用。拟南芥中,PRC2对H3.1和H3.3的活性没有偏爱性,并且H3.1和H3.3带有类似水平的H3K27me3。H3.1和H3.3的区别在于31, 41, 87和90四个位点,但A31赋予了H3.1可以被ATXR5/6单甲基化的性质。通过将这四个位点的氨基酸突变为H3.3的氨基酸,只有A31T不能恢复突变体h3.1kd的H3K27me3缺陷,表明了H3.1的K27保持了H3K27me3的水平。另外,突变体h3.1kd中,H3K27me3水平的降低与野生型中H3K27me1的富集相一致。此外,H3K27me1在等位基因atxr5;atxr6突变体中的缺失,降低了在h3.1kd突变体中H3K27me3基因中H3K27me3的富集程度。
综上说明在复制叉附近,ATXR5/6有选择的单甲基化H3.1的K27,从而提供H3K27me1作为PRC2的底物快速甲基化产生H3K27me3.
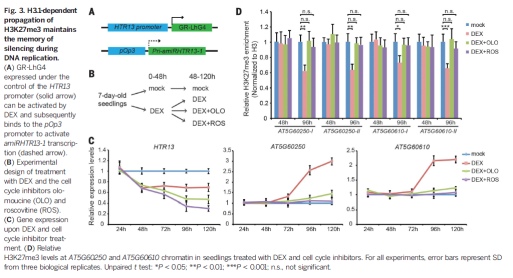
为进一步分析依赖于H3.1的H3K27me3的传代及其与DNA复制过程沉默记忆遗传过程中的联系,实验中在地塞米松处理条件下的htr3.1四突变体中用H3.1启动子启动amiRHTR13-1,检测处理对H3K27me3调控基因的表达。在地塞米松处理48h后HTR13的表达降低,但在处理96h后,H3K27me3的水平才降低,其调控基因的表达才升高。拟南芥细胞周期在17到48小时,说明在H3.1缺失情况下,一到两个细胞周期的DNA复制后,H3K27me3水平的稀释引起了转录的激活。地塞米松的作用可以被olo等处理阻断。这些结果表明与DNA复制协同的在H3.1上H3K27me3的保持是保持DNA复制过程中转录沉默所需要的。
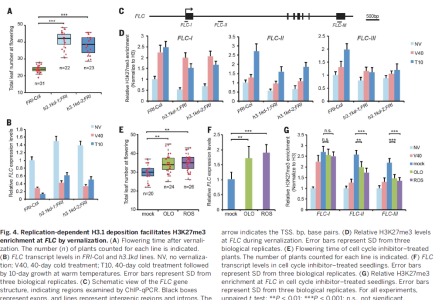
文中进一步分析了H3K27me3介导的开花前后的基因沉默机制。春化可以引起H3K27me3的富集,从而沉默开花抑制子FLC的表达。低温时,H3K27me3在FLC转录起始位点附近富集,并随着温度的升高,它向基因内部扩散。将需要春化才能促进开花的基因FRI导入到h3.1kd中,春化后,在h3.1kd中的开花时间推迟,FLC的表达增加。低温诱导的H3K27me3在FLC的转录起始位点检测到,但H3K27me3的保持和向FLC的扩散被破坏。在春化过程中,H3.3富集,FLC表达降低,而H3.1富集增加,并平衡了总体H3的水平。与拟南芥幼苗相比,成熟的叶片细胞中,春化后H3K27me3不再富集,并且H3.1的水平也不再提高。为分析H3.1,DNA复制和H3K27me3扩散之间的关系,通过阻断春化后细胞的分裂周期。相比未处理的植株,细胞周期阻断的植株表现出更高的FLC表达水平,并且H3K27me3的在FLC基因的扩散降低,开花更晚。综合上述结果,春化后,DNA复制中H3.1的结合促进了FLC染色质H3K27me3修饰,尽管H3K27me3在FLC基因内部的扩散可能与起始位点H3K27me3的修饰相对独立。
结论
在植物细胞中,PRC2复合体蛋白通过催化组蛋白H3.1的H3K27me3修饰抑制转录起始,保证DNA复制过程中的表观遗传调控。
亮点
文章通过一个系统的实验设计验证了一条全新通路的存在。
借鉴
1. 选择本文主要因为在整理即将推出的组蛋白修饰表观遗传学项目资料的过程中,发现这篇高分文章。为更深入的了解相关的知识,所以进行了整理与分享。本文研究了组蛋白修饰参与DNA复制过程中转录抑制调控的机制,通过生化、分子和遗传的证据进行了验证和解释,而最后通过一个大家都已经研究很透的FLC基因的研究将理论结果与表型关联起来。
2. CHIP-PCR在验证相关问题中的应用。
3. 本文的设计和实施是一个很复杂的过程,其中一定存在很多难以跨越的点,而从这些点中穿起这条线是一个很强的大脑才能完成的事。
艾比玛特医药科技(上海)有限公司
上海市徐汇区桂平路333号聚科生物园区1号楼1-3层
邮箱:market@ab-mart.com
应聘职位:hr@ab-mart.com
订购专线:4006-123-828
销售电话:13916964679(微信同号)
技术支持:15618194176(微信同号)
华南经销商负责(广东,广西,福建,海南):
程经理:手机18616261485(微信同号)
华北经销商负责(北京,天津,河北):
徐经理:手机15618191473(微信同号)
南方经销商负责:
陆经理:手机13122837132(微信同号)
北方及西南经销商负责:
张经理:手机13122150513(微信同号)

微信客服
邮箱:market@ab-mart.com
应聘职位:hr@ab-mart.com
订购专线:4006-123-828
销售电话:13916964679(微信同号)
技术支持:15618194176(微信同号)
华南经销商负责(广东,广西,福建,海南):
程经理:手机18616261485(微信同号)
华北经销商负责(北京,天津,河北):
徐经理:手机15618191473(微信同号)
南方经销商负责:
陆经理:手机13122837132(微信同号)
北方及西南经销商负责:
张经理:手机13122150513(微信同号)

微信客服
沪ICP备17056956号-2 艾比玛特医药科技(上海)有限公司