中文名:通过功能蛋白组学解析白血病细胞中Bcr-Abl激酶异构体p210和p190的信号网络差异
英文名:Differential signaling networks of Bcr–Abl p210 and p190 kinases in leukemia cells defined by functional proteomics
发表单位:瑞士洛桑联邦理工学院(EPFL)生命科学学院
杂志:Leukemia,2017
影响因子:11.702
文章摘要:
费城染色体易位(Philadelphia chromosome translocation)所形成的致癌性激酶Bcr-Abl有两个主要的异构体,即p210和p190。p210是慢性髓性白血病(chronic myelogenous leukemia)的标志,而p190主要出现在B细胞急性淋巴性白血病(B-cell acute lymphoblastic leukemia)里。与p210和p190驱动不同白血病的机制相关的蛋白互作差异和所激活的信号通路目前仍然是未知的。因此,本研究开展了一项针对p210和p190的定量比较蛋白组学研究。研究发现并证实了这两种激酶在蛋白互作组和酪氨酸磷酸化修饰组层面的显著差异。研究发现调控网格蛋白(clathrin)所介导的细胞内吞过程的AP2接头蛋白复合物更倾向于同p190发生相互作用,而磷酸酶Sts1则更倾向于同p210发生互作。此外,p210偏向激活转录因子Stat5和激酶Erk1/2,而p190则激活Lyn激酶。本研究的成果可以帮助研究者更全面地理解Bcr-Abl信号,白血病转化机理,疾病病理和激酶抑制剂响应等问题。

研究背景:
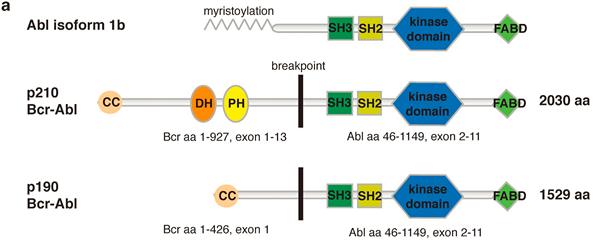
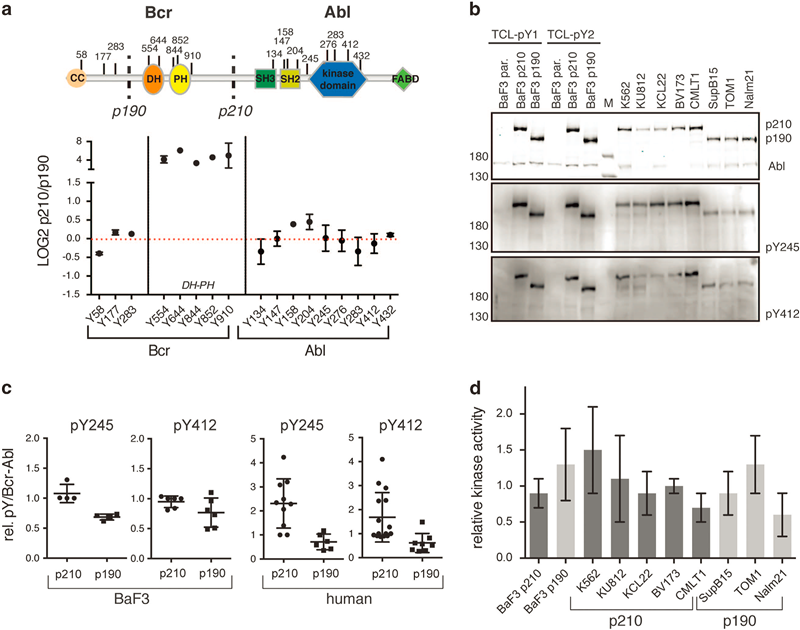
Bcr-Abl 是由费城染色体表达的一类持续激活型致癌性酪氨酸激酶,是临床上采用酪氨酸激酶抑制剂(如伊马替尼imatinib等)治疗白血病的重要靶点。费城染色体是白血病细胞中特有的因染色体易位形成的异常染色体,常见于慢性骨髓性白血病,偶见于急性淋巴性白血病和急性骨髓性白血病。费城染色体易位是将22号染色体上的BCR(breakpoint cluster region)基因基因与9号染色体上的ABL1(Abelson tyrosine kinase 1)基因融合到一起的过程。由于染色体易位的位点差异,Bcr-Abl有多个异构体(isoform),如p190,p210,p230等。其中,p190和p210是最常见的两种形式,二者的结构区别主要在于p190缺少了p210蛋白的N端(氮端)区域的DH-PH结构域(原文Figure 1a)。
已有的研究表明,p210是慢性骨髓性白血病(CML)的分子标志,也是足以驱动CML形成的单一致癌因子,而p190则更多地出现在B细胞急性淋巴性白血病(B-ALL)中。白血病研究领域一直认为p190和p210在致病性上的差异是与它们蛋白本身的内在差异有一定关联的,一些研究者也因此开展了对二者激酶活性,互作蛋白等层面的探究。但是在本研究之前,并无对p190和p210两者的系统、详细、定量的比较研究。因此,本研究利用SILAC标记质谱技术,在统一的细胞背景下,对p190和p210的互作蛋白组、酪氨酸磷酸化修饰组进行了系统性的定量比较研究,进而发现了两者在胞内信号调控上的一些显著性差异。
关键结果:
(一)实验系统和实验流程
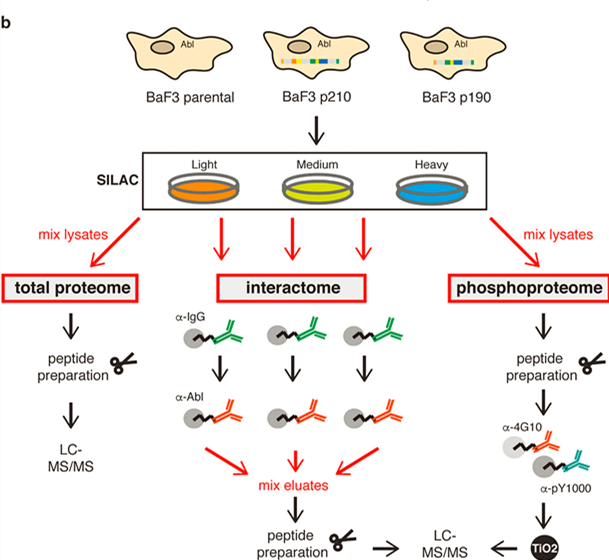
作者选用了小鼠原B细胞系BaF3作为背景细胞系,并应用逆转录病毒重组技术,构建了高表达p210和高表达p190 Bcr-Abl激酶的BaF3稳定细胞系,原细胞系则被标注为parental,表达内源性Abl激酶(原文Figure 1b)。
为了精准比较三种细胞系的蛋白组差异,作者应用了SILAC稳定同位素标记技术(即stable isotope labeling with amino acids in cell culture)。简要流程是使用带有不同“重量”同位素标记氨基酸的培养基培养细胞,使得不同细胞分别带有轻型(light,一般为正常)、中型(medium)、重型(heavy)同位素标记,随后即可进行细胞处理或裂解,不同标记的细胞样品混合后可同时进行比较,从而实现样品间的精准定量比较。
在互作组分析实验中,作者使用Abl抗体进行免疫富集(免疫球蛋白IgG用作对照)。通过分析Abl抗体富集的蛋白成分来了解三种细胞中与Abl激酶发生相互作用的互作组成分。酪氨酸磷酸化蛋白检测实验中,作者使用酪氨酸磷酸化修饰抗体pY1000和4G10来富集酪氨酸磷酸化肽段,并使用二氧化钛(TiO2)作进一步样品纯化。三种样品的混合总蛋白组被用作输入参考(input),肽段最后都采用液相色谱-质谱联用(LC-MS)手段分析。
(二)Bcr-Abl互作组鉴定、分析与验证
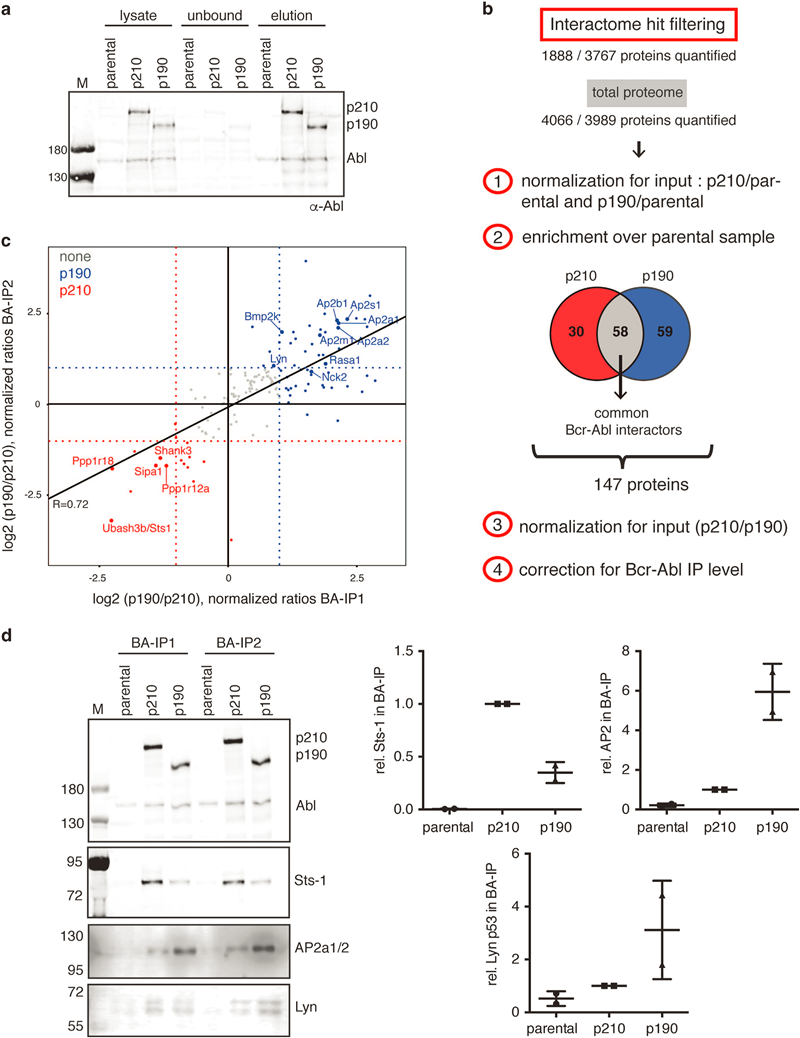
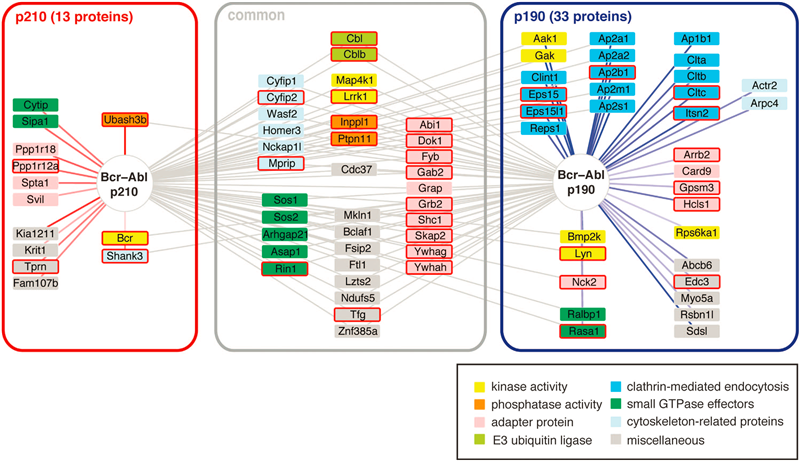
通过比对BaF3 parental/p210/p190细胞里被Abl抗体特异富集(去除IgG非特异结合)的蛋白成分,再比较BaF3 p210或p190相比于BaF3 parental细胞而言特有的蛋白组分,作者得到了p210和p190的互作蛋白组(包括p210特异互作蛋白,p190特异互作蛋白,通用型Bcr-Abl互作蛋白,见原文Figure 2)。本实验鉴定到的互作蛋白列表中有部分蛋白已被前人文献所报道,并且在数据处理时增加了IP水平的校正步骤,进一步保证了数据的可信性。
对通用型Bcr-Abl互作蛋白使用String网络分析(见原文Figure 3)得到两个明显的网络富集。第一个网络包含了大量酪氨酸激酶和Ras-MAPK激酶信号通路上的细胞质信号成分。第二个网络则包含了四元接头蛋白复合体AP2的全部组分和部分关联蛋白,AP2复合体在胞内参与了网格蛋白Clathrin介导的内吞过程。网络分析之后,作者挑选了部分鉴定靶标进行了实验验证。
(三)Bcr-Abl自身磷酸化位点和体外激酶活性的分析
由于Bcr-Abl酪氨酸激酶的活性调控过程涉及到自身磷酸化,因此为了探索p210和p190在激酶活性方面的差异,作者利用磷酸化蛋白组数据,专门对两种异构体自身的酪氨酸磷酸化修饰位点进行了质谱鉴定分析。作者在两种异构体上一共鉴定到了17个酪氨酸磷酸化位点,其中p210特有修饰位点5个(Y554, Y644, Y844, Y852 and Y910),其余位点的修饰并未在两种异构体间呈现明显差异。体外激酶活性测试显示p190和p210在体外激酶活性上没有明显差异(见原文Figure 4)。这些数据提示p190和p210的互作组差异可能是由其他的机制所引起的。
(四)全细胞酪氨酸磷酸化修饰组分析
P190和p210在互作蛋白组上有很明显的差异,那么这两种激活型的酪氨酸激酶对细胞质中整体的磷酸化修饰网络的影响是否有差别呢
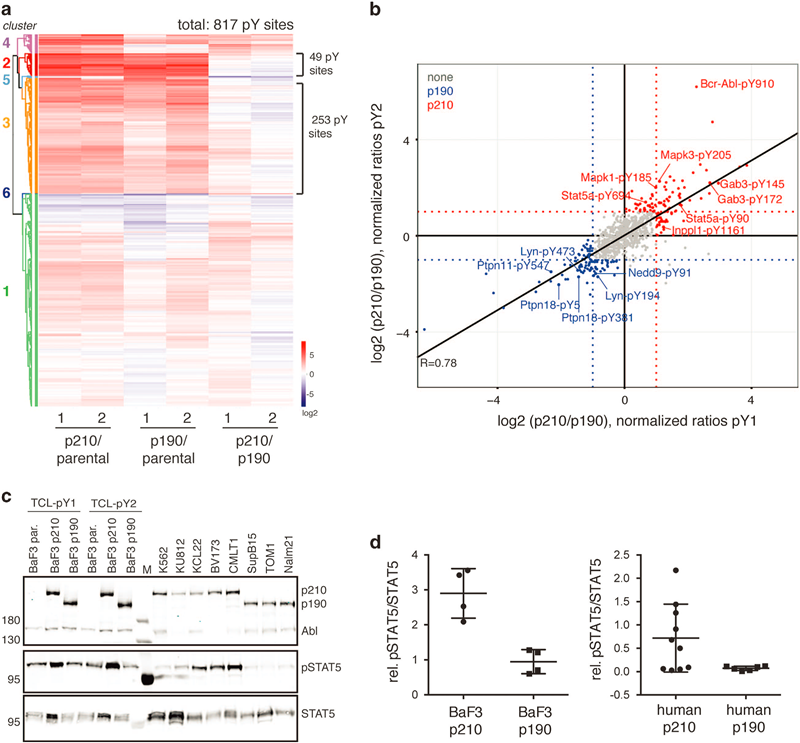
作者为此分析了BaF3 p210和p190两种细胞内相比于parental原始细胞呈明显变化的酪氨酸磷酸化修饰组分,鉴定到了817个酪氨酸修饰位点。聚类分析结果显示,超过37%的酪氨酸位点的磷酸化修饰水平在p210或p190组内呈明显上调,可以定位到多个Bcr-Abl作用蛋白或已被报道的Bcr-Abl底物蛋白上,一定程度上反映了这些磷酸化位点受控于激活的Bcr-Abl信号(见原文Figure 5)。
进一步比较p190和p210组间磷酸化修饰组的差异时,作者发现了转录因子Stat5a和Stat5b的激活型修饰和激酶Fes,Erk1/2,Fyn和Lck等分子的磷酸化修饰水平在p210表达的细胞中更高,而Lyn激酶、磷酸酶Shp2 (Ptpn11) 和 Flk1 (Ptpn18) 、接头蛋白Dok1和Pag1的磷酸化在p190表达的细胞中有更高水平。这些数据表明p190和p210在胞内信号调控网络上有明显差异(原文Figure 6)。

总结启示:
(1)本研究首次在统一的细胞背景下,系统比较了p190和p210这两种Bcr-Abl异构体的蛋白互作组、酪氨酸磷酸化修饰组的定量差异,并对代表性靶点或位点开展了实验验证,为理解两种异构体在白血病分型致病性的差异机理上提供了大量的参考信息。
(2)本研究的成果可能面临的挑战是,尽管作者一再强调使用统一细胞背景来比较p190和p210,但是这种人为制造的细胞系有可能过度简化了二者的调控差异因素,或者过度强化了蛋白本身的作用。白血病不同分型发病的过程很可能是有不同的遗传背景因素参与,并且这两种蛋白的绝对表达量的变化可能会与疾病发展过程有关联。直接检测具有不同p190/p210表达水平的不同发病阶段的病人样本可能会有更深入的发现。
(3)此外,这篇文章结果面临的另一层挑战是质谱数据的重复性以及SILAC标记技术在细胞培养上的时间成本。
(4)如果在本课题中应用抗体组学/抗体芯片筛选策略,
i)可以获得等规模数据量甚至更大规模数据量,并且技术重复性好,克服质谱技术重复性差的问题;
ii)可以直接检测多个样本,节省同位素替换标记的培养时间;
iii)可以在鉴定差异蛋白组获得大量关键候选差异蛋白的同时,获得大量可用于下游分析(WB,IP,ChIP,PTM修饰)的抗体,由此不仅可以对互作组里的关键蛋白开展直接的内源验证,也可以对关键蛋白本身的修饰变化及其所调控的其他蛋白的修饰变化开展不限于酪氨酸磷酸化的修饰组研究,从而获得更丰富的蛋白调控网络信息。也可以选取关键蛋白,在临床样本中做进一步的验证或差异蛋白组分析。
iv)非靶向性芯片筛选差异样本中的差异蛋白点,可以避免课题前期的假说或预测的主观影响,基于数据分析可以得到更客观的结论。
延伸评论:
抗体组学(抗体芯片)技术是一种新兴的非靶向性高通量功能蛋白组学研究手段,在筛选差异蛋白的同时可以向研究者提供适用于多种下游蛋白质分析实验的单克隆抗体,因而在差异样本的研究中具有明显的应用优势。
当前的抗体市场主要流通的是识别人源蛋白或啮齿类模式动物蛋白的抗体,但对于农林牧渔领域的研究者来说,市场上一直稀缺针对他们所研究的特色动植物蛋白的优质抗体,直接导致这些研究者无法深入研究所关注的重要蛋白功能。
抗体组学(抗体芯片)技术从高质量、高通量、高灵敏度的单克隆抗体芯片出发,直接比较具有表型或性状差异的样本(如不同致病力的病原菌,不同甜度的果实,不同耐寒能力的植物群落等)中蛋白组的变化,监测抗体芯片上的信号差异,从差异抗体组中利用生物信息学分析手段进一步发掘关键抗体点(蛋白点),利用抗体点所对应抗体回溯至原样本开展WB实验验证芯片筛选结果,再挑选得到双重验证的抗体点,鉴定抗体识别的蛋白。对于这些关键蛋白,研究者就可以得到立时可用的单克隆抗体,应用于WB,IP,ChIP等多种下游分析。
利用识别关键蛋白的抗体,研究者可进一步探究并验证以关键蛋白为轴心的蛋白互作网络(IP-MS和Co-IP)和该蛋白本身的翻译后修饰(IP-MS),乃至蛋白互作网络内其他重要蛋白的互作网络和翻译后修饰,更可以在不同处理条件或不同表型的样本中比较同一轴心蛋白的互作网络和修饰变化,开展差异互作组和差异修饰组分析,从而勾绘所关注样本中蛋白网络的动态图谱。相比于基因组、转录组和基于质谱的常规蛋白组学技术手段,抗体组学技术在筛选和发现关键调控蛋白的同时,一步到位提供工具抗体用于蛋白功能验证,使研究思路进一步加深扩宽,在多组学联合分析中对组学系统数据利用得更为充分。
由此可见,抗体组学策略可以在提供更稳定的实验结果,更丰富的候选靶点,更全面的下游验证工具和更持久的研究思路,进而帮助研究者发表更高水平的研究成果。
艾比玛特医药科技(上海)有限公司
上海市徐汇区桂平路333号聚科生物园区1号楼1-3层
邮箱:market@ab-mart.com
应聘职位:hr@ab-mart.com
订购专线:4006-123-828
销售电话:13916964679(微信同号)
技术支持:15618194176(微信同号)
华南经销商负责(广东,广西,福建,海南):
程经理:手机18616261485(微信同号)
华北经销商负责(北京,天津,河北):
徐经理:手机15618191473(微信同号)
南方经销商负责:
陆经理:手机13122837132(微信同号)
北方及西南经销商负责:
张经理:手机13122150513(微信同号)

微信客服
邮箱:market@ab-mart.com
应聘职位:hr@ab-mart.com
订购专线:4006-123-828
销售电话:13916964679(微信同号)
技术支持:15618194176(微信同号)
华南经销商负责(广东,广西,福建,海南):
程经理:手机18616261485(微信同号)
华北经销商负责(北京,天津,河北):
徐经理:手机15618191473(微信同号)
南方经销商负责:
陆经理:手机13122837132(微信同号)
北方及西南经销商负责:
张经理:手机13122150513(微信同号)

微信客服
沪ICP备17056956号-2 艾比玛特医药科技(上海)有限公司