Conserved Fever Pathways across Vertebrates: A Herpesvirus Expressed Decoy TNF-a Receptor Delays Behavioral Fever in Fish
英文标题:Conserved Fever Pathways across Vertebrates: A Herpesvirus Expressed Decoy TNF-a Receptor Delays Behavioral Fever in Fish
中文标题:脊椎动物发热的保守代谢路径:在鱼中一种疱疹病毒表达的诱饵TNF-α受体延缓了发热行为
发表单位:比利时列日大学
发表杂志:Cell Host & Microbe(IF:12.328)Cell Host & Microbe
http://dx.doi.org/10.1016/j.chom.2017.01.010
解读人:张婧
文章摘要
恒温动物和冷血动物(比如鱼)都可以通过提高体温减少病原体的侵染。冷血动物可以移动到温度较高的地方,因此有了名字“行为性发热”。在普通的鲤鱼中接种鲤科疱疹病毒3型,研究行为性发热行为,其中鲤科鱼疱疹病毒3是一种本地的鲤鱼病原体。感染病毒之后,鲤鱼在24℃即可死亡。然而,将这些感染病毒的鱼放在24-32℃不同温度梯度的箱子里,它们会趋向于游在温度最高的水缸中并且存活下来。这种热趋向行为仅仅在病毒感染的晚期才得以体现。与之一致的是,CyHV-3 ORF12可以编码TNF-α一种可溶性的阻滞受体在温度梯度的鱼缸中延缓鲤鱼热趋向行为的出现,加快CyHV-3的复制过程。向感染病毒的鲤鱼中注射抗TNF-α的抗体可以抑制热趋向行为的发生,同时降低鱼的存活率。本研究为病毒如何在进化过程中改变宿主的行为以提高自身的存活率方面提供了独特的证据。
研究背景
本文需要了解的两个前提:
A、鲤鱼的体温与环境温度基本一致;
B、在一定温度范围内,CyHV-3病毒在温度升高时复制能力下降。
1、什么是热趋向行为
当遭遇病原体入侵时,恒温动物和冷血动物都可以通过升高体温限制入侵的过程。在恒温动物中,这种抵抗外界侵染最基本的机制被称为发热。研究表明,发热主要依赖于生热反应,同时生理和行为学的调控机制也可以减少生物体的热损失。除了极端的例子以外,冷血动物体内缺乏生热机制,因此机体的温度与环境温度非常接近。根据环境温度,冷血动物在进化过程中出现了温度梯度的变化范围,这个体温的变化范围称为FTP。作为对病毒侵染和外源性热源注射的应答,冷血动物可以提高体温,甚至超过FTP的范围,从而迁徙到温度更高的环境中。这种现象被称为行为性的热趋向,被定义为在应答病毒侵染时FTP连续性准确性的升高。目前,热趋向行为在冷血动物中被广泛报道,其中包括脊椎动物(鱼、两栖类动物、爬行类动物)和非脊椎动物。
2、研究现状
冷血动物中热趋向行为在在相关调控通路的不同调控水平的进化机制上与恒温动物的发热行为有关,这其中包括作为诱导物的外源性致热源发挥的功能、下丘脑视前区作为外源热信号整合位点发挥的重要作用以及前列腺素作为效应调节器的重要功能。然而,没有研究表明这种进化关系可以延伸至内源的热源中,也就是说细胞调控因子可以告诉大脑外源性致热源可以被免疫细胞所识别。在恒温动物中,一些细胞因子,比如白细胞介素-1β,IL6,肿瘤坏死因子α(TNF-α),都可以作为内源性热源应答的响应因子。
至少在一些侵染模型中,恒温动物发热以及冷血动物的热趋向行为均可以提高宿主的存活率。这种有益的效果是体温升高的结果,它可以提升先天性以及适应性免疫调控机制的效率,从而限制入侵病原体的复制过程。病原体通过表达特定基因病原体可以操控宿主的所有生理学过程,从而为病毒自身复制和侵染过程扫清障碍。但截至到目前为止,没有研究表明病原体可以影响宿主发热行为。
在普通鲤鱼以及锦鲤中,疱疹病毒3(CyHV-3)是一种致死性的,高传染性的病原体。CyHV-3的侵染力主要依赖于体内和体外的温度。在18-28℃时,CyHV-3可以在体内和体外均进行复制,但是超过30℃时可以迅速抑制该病毒在鲤鱼体内和体外的复制过程。在我们对CyHV-3病原体的研究中发现,侵染24h后的鲤鱼(在FTP范围内的健康鲤鱼)更倾向于生活在温度较高的鱼缸中。这个研究结果驱使我们假设,当存在温度梯度时,被侵染的个体在自然环境中更容易表现出热倾向趋势。
本文我们使用CyHV-3和鲤鱼作为病毒-宿主模型研究热趋向行为。我们发现该病毒可以通过影响单个基因的表达改变宿主的行为。同时,本文的研究发现TNF-α可以在冷血动物中作为发热行为的中间调控因子。
与蛋白功能研究相关的关键成果
一、
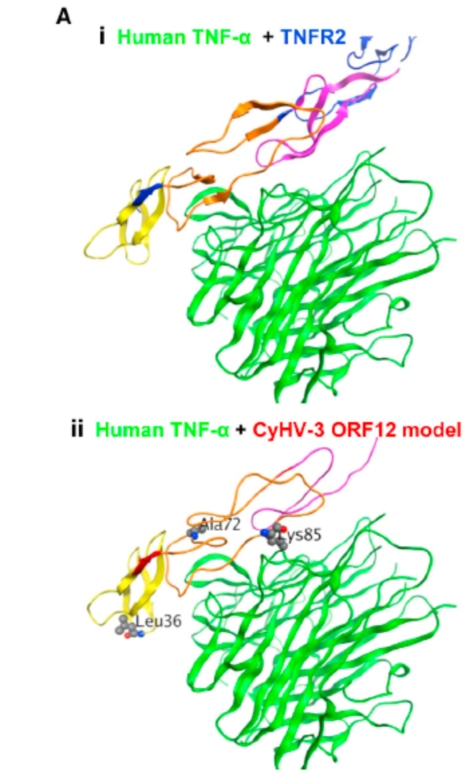
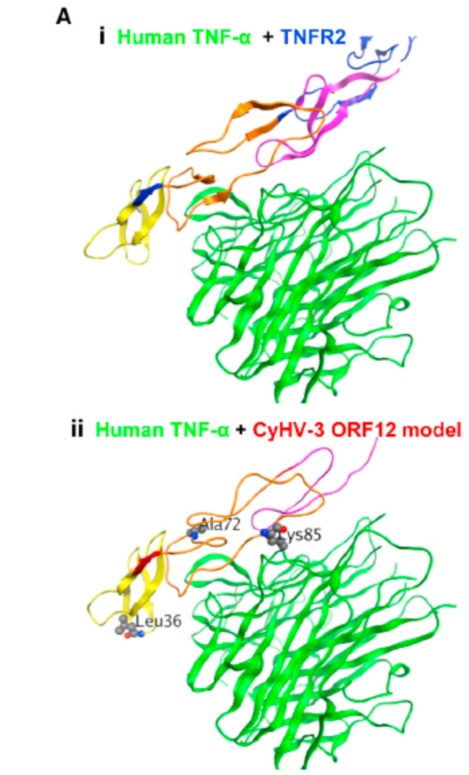
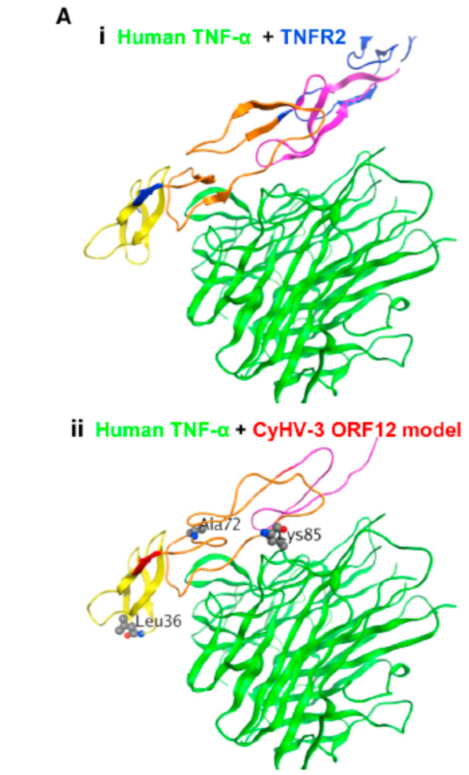

根据作者最初的假设,ORF12可以作为可溶性的诱饵受体中和高热的细胞因子。ORF12编码了一个假定可溶的TNF受体类似物,在恒温动物中,TNF-α是内源性制热物。本研究想探索ORF12是否编码TNF-α的可溶性诱饵受体。通过使用Pfam软件,将鲤鱼ORF12蛋白的氨基酸序列与人的TNFR2的氨基酸序列进行比对。TNFR2有3个TNFR_c6结构域,ORF-12有2个该结构域,同时还有一个片段。已经解析的人TNF-TNFR2复合体(Ai)可以用于建立CyHV-3 ORF12的同源模型(Aii)。在1.771A°的水平上将两种模型叠加后可以得到图Aiii。同源模型的建立表明ORF12形成了一种包含有两个TNFR_c6的功能结构域,并且可以结合TNF-α。
二、

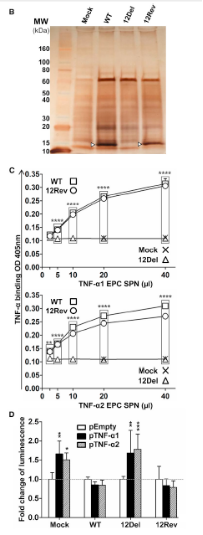
为了验证ORF12可以编码功能性可溶的TNF-α受体,取被CyHV-3、12Del和12Rev侵染的细胞上清液,浓缩离心。总蛋白银染之后的结果证实了ORF12(预测的分子量为12.6kDa)在CyHV-3的蛋白质组中是领先的病毒蛋白(B)。
为了检测ORF12与鲤鱼TNF-α结合的能力,在与鲤鱼TNF-α1或者TNF-α2(C)共同孵育之前,将离心浓缩后的细胞培养液中的蛋白通过ELISA进行检测。鲤鱼TNF-α1和TNF-α2是哺乳动物TNFSF2(TNF-α)家族中的同系物。TNF-α结合的定量化研究表明,在野生型和12Rev侵染的上清液中均检测到了TNF-α结合因子的活性,这一点与12Del和模拟物侵染的上清液情况相反(图C)。
该结果通过ELISA实验结合不同的检测系统(含有抗组蛋白标签的单克隆抗体)得以证明。接下来,使用双荧光素酶报告系统检测ORF12和TNF-α的结合是否可以抑制其激活NF-κB信号通路的能力(图D)。取模拟物或者12Del侵染细胞的上清液共同孵育的结果表明,鲤鱼TNF-α1和TNF-α2激活NF-κB信号通路的能力类似。但是向细胞的培养基中加入细胞因子时,野生型或者12Rev上清液中的激活机制可以被抑制(图D)。
这些数据表明,ORF12可以编码一种可溶性的TNF-α受体抑制鲤鱼中TNF-α1和TNF-α2的活性。
文章核心思路
1、观察鱼类在病毒侵染后不同温度下的行为表现
方法:计数(p<0.001)
结论:感染CyHV-3之后鲤鱼有发热行为,并且趋向于游在温度较高的环境中。
2、观察不同温度下感染CyHV-3鲤鱼的存活率
方法:统计存活率(P=0.004)
结论:感染CyHV-3之后具有发热行为,即生活在更高温度环境中的鲤鱼存活率较高。
3、探究为什么在病毒入侵的晚期,鲤鱼才出现热趋向行为
方法:根据以往研究(Epperson et al., 2012、Yi et al., 2015)提出假说,认为
CyHV-3病毒分泌了一种诱饵蛋白受体可以中和鲤鱼发热产生的细胞因子从而影响热趋向行为的出现。前期研究表明CyHV-3 ORF12在CyHV-3病毒的分泌蛋白中大量存在,并且它能够编码TNF受体同系物
结论:将CyHV-3 ORF12列为本文的研究目标。
4、在24℃下探索CyHV-3是否通过调控ORF12蛋白的表达影响鲤鱼热趋向行为的出现
方法:在CyHV-3中构建ORF12敲除的品系(12Del)和ORF回复突变的品系(12Rev)。将构建好的突变病毒株在细胞水平检测毒力后接种鲤鱼,
并将鲤鱼置于24℃下进行饲养,分别观察其存活率和表型变化。
结论:接种了12Del和12Rev后的鲤鱼并未出现表型差异。即,在24℃下,ORF12并未影响鲤鱼热趋向行为。
5、在不同温度梯度条件下探索CyHV-3 ORF12是否影响鲤鱼热趋向行为
方法:将鱼分为两组,分别接种12Rev和12Del
结论:接种12Del的鱼较早出现热趋向行为,出现感病的症状较少。即,CyHV-3
可以通过调控一个蛋白即ORF12的表达影响宿主的热趋向行为的发生,从而使自身的复制过程更加顺利。
6、探索ORF12延缓发热行为出现的分子机理
方法:使用Pfam比较鲤鱼ORF12和人TNFR2蛋白的氨基酸序列,绘制CyHV-3 ORF12的蛋白结构模型。分别收集侵染WT、12Rev和12Del三种病毒的细胞培养基上清液,提取总蛋白银染后分析发现ORF12在三种样品中的表达量均为最高。ELISA检测ORF12与TNF-α结合的能力。双荧光素酶报告系统检测ORF12与TNF-α结合后是否能够抑制TNF-α激活NF-κB信号通路。
结论:ORF12可以编码TNF-α(内源性发热因子)的可溶性诱饵蛋白的受体
抑制鲤鱼中TNF-α1和TNF-α2的表达。
7、探索TNF-α在鲤鱼中是否也和在温血动物中一样作为细胞内的发热因子发挥功能
方法:向侵染CyHV-3 WT的鲤鱼腹腔中注射抗TNF-α中和的抗体并且和注射无关抗体的鱼行为进行比较。
结论:在干扰了TNF-α被抑制的过程之后,鲤鱼的热趋向行为明显下降,存活率显著降低。在侵染了CyHV-3的鲤鱼中,TNF-α可以作为鲤鱼热趋向行为的中间调控因子发挥功能。

![]()
![]()

![]()


